ویروس پاپیلومای انسانی (HPV)
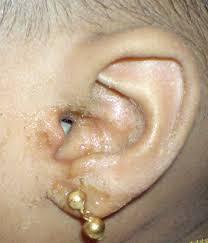
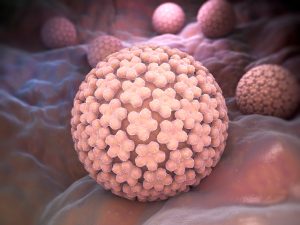
ویروس پاپیلومای انسانی (HPV) یکی از شایعترین عفونتهای مقاربتی است که میتواند باعث زگیل تناسلی و انواع سرطان، بهویژه سرطان دهانه رحم، شود. تشخیص زودهنگام این ویروس با روشهای پیشرفتهای مانند Real-Time PCR و واکسیناسیون میتواند در پیشگیری و مدیریت