آزمایشات ناباروری شامل موارد زیر می شود:
انواع آزمایش ناباروری:
آنالیز اسپرم
SMT
SDF
PCT
آزمایش آنالیز اسپرم:
آنالیز اسپرم به روش کامپیوتری CASA و با دقت کامل علاوه بر حجم و میزان ویسکوزیته، تعداد اسپرم ها در میلی لیتر، نوع تحرک و شکل اسپرم ها (مرفولوژی) بصورت درصد گزارش می گردد.
آزمایشSMT: در این آزمایش میزان تحرک اسپرم ها قبل و بعد از شست و شو و Swim up اندازه گیری می گردد. این آزمایش برای افرادی که قصد IUI (تلقیح داخل رحمی) دارند کاربرد دارد.

آزمایشSDF یا شکست DNA اسپرم: این آزمایش برای آقایانی که آنالیز نرمال داشته و بیش از یکسال تلاش برای بارداری ناموفق داشته اند و یا زوجینی که سقط های مکرر دارند، انجام می شود، میزان شکستگی DNA بصورت درصد گزارش می گردد.
DFI بررسی میزان شکست DNA اسپرم (روشی برای بررسی ناباروری در مردان)
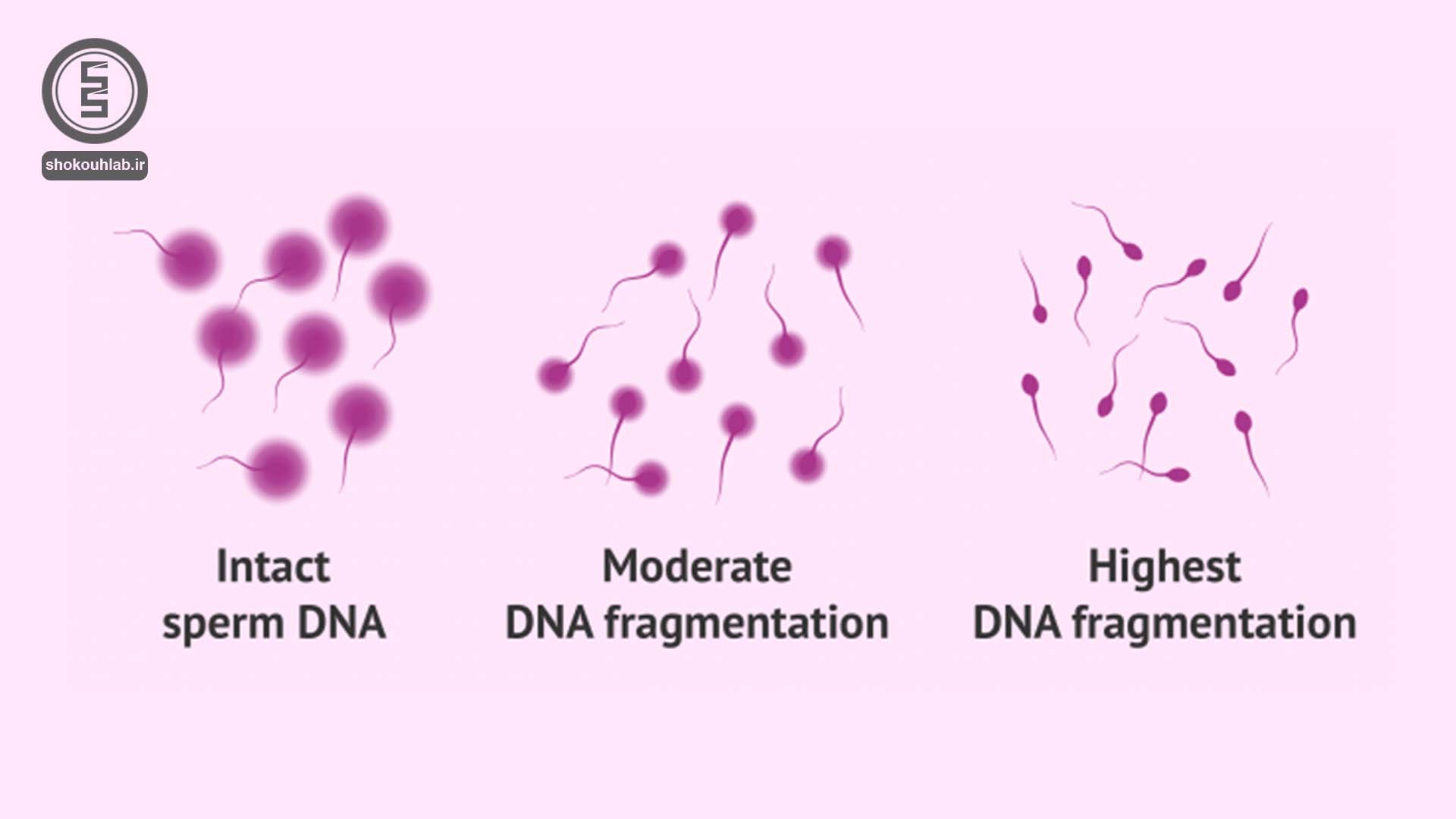
تست DFI آزمایشی است که برای بررسی ناباروری مردان به کار می رود که در آن میزان شکست DNA اسپرم مشخص می شود. در واقع به زبان ساده کاربرد تست DFI، در بررسی میزان قطعه قطعه شدن DNA اسپرم می باشد.
علل ناباروری مردان حدود %20 از کل موارد ناباروری را شامل می شود اما هنگامی که با عوامل زنانه ترکیب شوند، در حدود 30 تا 40 درصد موارد نقش دارند. تا به امروز، ارزیابی ناباروری مردان، بر اساس استانداردهای سازمان بهداشت جهانی (WHO)، شامل بررسی تعداد کل اسپرم، تحرک و مورفولوژی می باشد. از این میان، مورفولوژی غیر طبیعی اسپرم نه تنها بر میزان لقاح موفقیت آمیز و میزان بارداری در هر چرخه موثر است بلکه خطر سقط جنین را افزایش می دهد، حتی اگر انتقال جنین از طریق روش های کمک باروری موفقیت آمیز باشد.
در حقیقت، در بسیاری از موارد، ناباروری مردان به علت نقص در DNA اسپرم ایجاد می شود، که تجزیه و تحلیل کیفیت مایع منی (آزمایش اسپرموگرام) هنوز قادر به تشخیص آن نیست. بنابراین برای پیش بینی ناباروری مردان باید بررسی میزان شکست DNA اسپرم یا همان تست DFI انجام گیرد که از ارزش تشخیصی و پیش آگهی بهتری نسبت به پارامترهای معمول مایع منی برخوردار می باشد.
اخیراً، مطالعات بسیاری نشان داده اند که یکپارچگی DNA برای لقاح تخمک ها ضروری است و نشانگر باروری مردان است و همچنین میزان آسیب DNA اسپرم در مردان مشكوك به ناباروری در مقایسه با مردان بارور بیشتر گزارش شده است. در واقع در تست DFI با استفاده از روش های مختلف مانند TUNEL، SCSA و SCD میزان قطعه قطعه شدن یا شکست DNA اندازه گیری و بررسی می شود.
علل شکست DNA اسپرم در ناباروری مردان
ناباروری با عامل مردانه کاملا متداول است زیرا 30 تا 50٪ موارد ناباروری مردان به دلیل مشکلات اسپرم رخ می دهد. قطعه قطعه شدن بالای DNA اسپرم یکی از دلایل ناباروری مردان محسوب می شود و عوامل زیادی می توانند باعث قطعه قطعه شدن و آسیب به DNA اسپرم شوند که می توانند ناشی از سرطان، عفونت، مصرف مواد مخدر، تب بالا، بالا رفتن دمای بیضه، آلودگی هوا، استعمال سیگار، مصرف الکل، استرس، رژیم غذایی نادرست، آلاينده هاي محيطی و شغلي، واریکوسل و افزایش سن باشند که با بررسی میزان شکست DNA اسپرم می توان بهترین گزینه درمانی را به زوج های نابارور معرفی کرد و شانس بچه دار شدن را افزایش داد.
تفسیر تست DFI:
تفسیر این تست و پس از آن درمان شکست DNA اسپرم به انتخاب بهترین درمان ناباروری کمک میکند و احتمال موفقیت در روش های کمک باروری را افزایش میدهد و به صورت زیر انجام می گیرد:
- میزان DFI کمتر از 15 درصد: وضعیت DNA اسپرم عالی است؛
- میزان DFI 15 تا 25 درصد: وضعیت DNA اسپرم در محدوده طبیعی است؛
- میزان DFI 25 تا 50 درصد: وضعیت DNA اسپرم ضعیف است؛
- میزان DFI بیشتر از 50 درصد: وضعیت DNA اسپرم بسیار ضعیف است.
تست DFI در چه مواردی توصیه می شود؟
از موارد کاربرد تست DFI یا بررسی میزان شکست DNA اسپرم، می توان به آیتم های زیر اشاره کرد:
- تست DFI یکی از پارامترهایی است که در ناباروری های بدون دلیل بررسی می گردد؛
- همچنین در بررسی علل متوقف شدن رشد جنین از این تست استفاده می شود.
- یکی دیگر از موارد کاربرد تست DFI، هنگامی است که رشد ضعیف جنین وجود دارد؛
- در زمان شکست مکرر روش های کمک باروری مانند IVF / ICSI نیز از تست DFI استفاده می شود؛
- همچنین بررسی علل سقط مکرر جنیناز دیگر موارد کاربرد تست DFI می باشد؛
- سن بالای آقا؛
- وجود واریکوسل؛
- وجود پارامترهای غیرطبیعی در آزمایش آنالیز اسپرمعلی الخصوص مورفولوژی اسپرم؛
- و همچنین قرار گرفتن در معرض مواد مضر، از دیگر موارد کاربرد تست DFI می باشند.
درمان شکست DNA اسپرم
برای درمان شکست DND اسپرم، عوامل مختلفی تاثیر گذارند که در ادامه به آن ها اشاره می کنیم.
- تجویز دارو در صورت وجود عفونت یا تب بالا یکی از روش های درمان شکست DNA اسپرم می باشد؛
- از دیگر اقداماتی که برای درمان شکست DNA اسپرم انجام می گیرد، اصلاح سبک زندگی می باشد که شامل موارد زیر است:
-ترک مواد مخدر، سیگار و الکل
-کاهش استرس
-ترک شغل های در محیط گرم یا نشسته
-داشتن رژیم غذایی سالم و مصرف غذاهای تازه به ویژه آنتی اکسیدان ها یا ویتامین C و E؛
- درمان واریکوسل در صورت وجود نیز در درمان شکست DNA اسپرم مؤثر می باشد؛
- جایگزین کردن روش های کمک باروری هدفمندتر یعنی ICSI یا میکرو اینجکشن به جای IVF نیز یکی دیگر از روش های درمان می باشد.
تست بعد از نزدیکی (PCT):
این آزمایش برای بررسی ترشحات زنان پس از نزدیکی بعمل می آید، که احتمال بارداری در این تست بررسی می شود.
تست بعد از نزدیکی (Post Coital Test) که به تست PCT معروف است،این تست از نخستین آزمایش هایی است که برای شناسایی علت ناباروری در زنان به کار رفته و به بررسی ترشحات دهانه رحم میپردازد. در حالت طبیعی، تحت تأثیر هورمونهای زنانه نظیر استروژن، از واژن بانوان ترشحاتی خارج میشود.
این ترشحات بدون بو، شفاف و روشن است. ترشحات واژینال به دلیل خاصیت چسبندگی و رقیق بودن خود، فضای مناسبی را در واژن و رحم ایجاد میکند که باعث شناور شدن و حرکت راحت اسپرم و درنتیجه رسیدن آن به تخمک میشود. بررسی این ترشحات بهویژه جهت تشخیص زمان تخمکگذاری اهمیت بسیاری دارد.
درواقع، سرویکس یا دهانه رحم با نقشآفرینی در محافظت از اسپرمها و ایجاد محیط مغذی، بیشترین موکوس را درست قبل از زمان تخمکگذاری و بر اثر تغییرات هورمون استروژن ترشح میکند. موکوس دهانه رحم بهعنوان مادهای آبکی و کشسان، حرکت اسپرم تا رسیدن به تخمک را تسهیل مینماید که سنجش کمیت و کیفیت آن نیز توسط یک اسپکولوم صورت میگیرد.
این بررسی که تحت عنوان تست PCT یا تست بعد از نزدیکی شناخته میشود، مشابه تست پاپ اسمیر در حدود ۴ الی ۱۲ ساعت پس از نزدیکی (حدود زمان تخمکگذاری) انجام میشود؛ همچنین در این بررسی علاوهبر وضعیت مخاط سرویکس، نحوه جابجایی اسپرم در آن نیز مشخص میشود.
نتیجه آزمایش بعد از نزدیکی
در حالت طبیعی باید در این نمونه گرفته شده از واژن، اسپرم ها دارای شکل و حرکت طبیعی باشند که در این صورت پزشک تشخیص می دهد زوج از نظر ایمنی و عبور اسپرم از دهانه رحم مشکلی ندارند و احتمالاً ناباروری آنان علت دیگری دارد. اما در صورتی که نتایج آزمایش نشان دهد که آنتی بادی های ضد اسپرم در بدن خانم ترشح می شوند، پزشک استفاده از روش های کمک باروری نظیر IUI و IVF را تجویز می کند.
مطلب پیشنهادی: هر آنچه که باید در مورد واکسن HPV بدانیم
علت منفی شدن آزمایش
معمولاً نتیجه منفی شدن تست بعد از نزدیکی به عدم وجود اسپرم یا بیحرکت بودن همه اسپرمها در موکوس اشاره دارد و مواردی که سبب منفی شدن تست میشود عبارتند از:
- انجام تست در زمان اشتباه و خیلی زودتر یا خیلی دیرتر از تخمکگذاری
- عدم وقوع تخمکگذاری در آن سیکل قاعدگی به علت استرس و اضطراب یا تعیین غلط زمان مقاربت جنسی
- کم بودن تعداد و تحرک اسپرمها
- غیرطبیعی بودن دهانه رحم در اثر عفونت مزمن، زخم در دهانه، جراحیهایی همچون مخروطبرداری دهانه رحم و…
- مصرف داروهایی با اثر منفی بر تولید موکوس خوب و کافی
- عفونتهای مزمن رحم
علت مثبت شدن تست PCT:
مثبت شدن نتیجه تست PCT نیز نشاندهنده موارد زیر است و به انتخاب روش درمانی مناسب کمک میکند:
- تولید کافی اسپرم در مرد
- طبیعی بودن غدد دهانه رحم
- قرارگیری صحیح اسپرم در واژن طی مقاربت جنسی
- عدم وجود آنتیبادیهای ضداسپرم در موکوس
- تولید کافی استروژن قبل از تخمکگذاری و درنتیجه روند طبیعی تخمکگذاری
اقدامات متناسب با نتیجه تست PCT
در کل، باید ذکر کرد که معمولاً برای تأیید نتیجه منفی آزمایش پیسیتی (PCT)، آزمایش چند بار در شرایط مناسب تکرار میشود تا پزشک از منفی بودن نتیجه اطمینان یابد. بدین ترتیب اگر وضعیت موکوس خوب باشد، یک قطره از موکوس تازه در کنار یک اسپرم تحت میکروسکوپ قرار داده میشود که عملکرد آنها بررسی گردد.
طی این آزمایش که به تست نفوذ اسپرم یا تست نفوذ موکوس داخل آزمایشگاهی معروف است، اگر اسپرم پس از ۱۵ دقیقه تحرک مناسبی از خود نشان دهد یا به موکوس نفوذ نکند، احتمال وجود آنتیبادی ضد اسپرم در نظر گرفته میشود. بنابراین بر حسب تشخیص پزشک، آزمایشهای تکمیلی صورت میگیرد و مشکلات دهانه رحم براساس آن اصلاح میشود.